2013年 明大中野中学の問題です。
塩酸にマグネシウムという金属を入れると、マグネシウムは溶けていき、水素が発生します。このとき、水溶液中には塩化マグネシウムという物質ができています。水溶液中にできている塩化マグネシウムの重さは、反応した塩酸やマグネシウムの重さに比例します。
グラフは、ある濃さの塩酸100mLに入れたマグネシウムの重さと、そのとき発生した水素の体積の関係を表したものです。
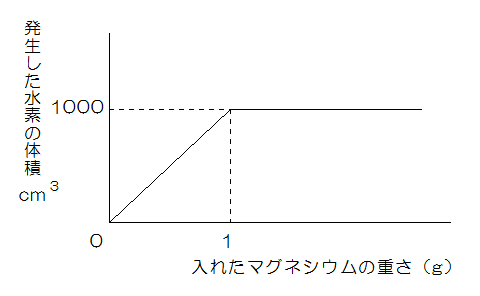
また、マグネシウム0.5gを入れたとき、水溶液中にできていた塩化マグネシウムの重さは2gでした。次の問いに答えなさい。
(1)この塩酸350mLにマグネシウムは何gまで溶けますか。
(2)この塩酸80mLにマグネシウムを0.6g入れたとき、水素は何cm3発生しますか。
(3)この塩酸300mLに、ある重さのマグネシウムを入れるとマグネシウムはすべて溶けました。このとき、水溶液中に塩化マグネシウムが3gできていたとすると、あと何gのマグネシウムが溶けますか。
この問題では、まずグラフから
100mLの塩酸には1gのマグネシウムが溶け、水素が1000cm3出ることがわかります。
またマグネシウムを0.5g入れたときは、当然、すべて溶けるわけですが、このとき塩化マグネシウムは2gできるので、マグネシウム1gが全部溶けると、塩化マグネシウムは4gできることになります。
したがってこの関係は
100mLの塩酸→マグネシウム1g→水素1000cm3→塩化マグネシウム4g
ということになり、あとは比例関係で考えていけばよいことになります。
(1)で塩酸が350mLですから、塩酸の量が3.5倍になったので、マグネシウムも3.5倍になるから溶けるマグネシウムは3.5gです。
(答え)3.5g
(2)塩酸が80mLのときは、0.8倍ですから、溶けるマグネシウムは0.8gです。しかし、マグネシウムは0.6gしかないので、水素は0.6g分しか発生しません。
したがって1000×0.6=600cm3になります。
(答え)600cm3
(3)300mLの塩酸があるとき、この反応は
300mLの塩酸→マグネシウム3g→水素3000cm3→塩化マグネシウム12g
となります。
しかし、塩化マグネシウムが3gでしたから、4分の1なので、マグネシウムは3×=0.75gしか溶けていません。
ですから、あと3-0.75=2.25gのマグネシウムを溶かすことができます。
(答え)2.25g
==============================================================
中学受験で子どもと普通に幸せになる方法、本日の記事は
早くも模擬試験
==============================================================
中学受験 算数オンライン塾
4月5日の問題
==============================================================

==============================================================

==============================================================
![]()
にほんブログ村








