2014年雙葉中学の問題です。
石灰石や大理石の主成分は炭酸カルシウムと呼ばれるものです。炭酸カルシウムと濃度の決まっている塩酸を用いて、二酸化炭素を発生させる3つの実験を行いました。ただし、実験1、実験2では炭酸カルシウムや塩酸はそれぞれ等しい量を用いました。
【実験1】
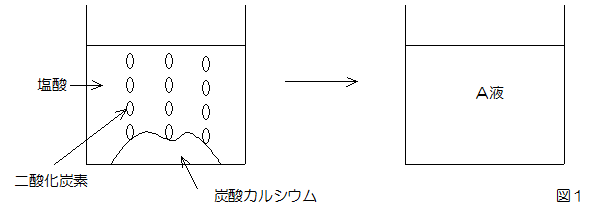
図1のように、ビーカーに大さじ1杯の炭酸カルシウムの粉末を入れ、これをすべて溶かすのに十分な量の塩酸を加えたところ、二酸化炭素を発生し、無色透明な液体(A液)が残りました。次に、A液を少量試験管に分け取り、BTB液を加えたところ( ア )色になり、(a)A液は( イ )性であることがわかりました。 また、(b)A液を蒸発皿に入れ、ガスバーナーで加熱すると白色の固体Bが得られました。 この固体Bを少量取って、試験管に半分くらい入れた水に溶かし、BTB液を入れたところ緑色になりました。
問1 文中の( ア )、( イ )に適する言葉を入れなさい。
問2 A液について次の(1)、(2)に答えなさい。
(1)下線部(a)のようになるのは、A液に2つのものが含まれているからです。これらの名前を答えなさい。
(2)下線部(b)で蒸発皿から出ていくものをすべて答えなさい。
問3 下の丈は、炭酸カルシウムと固体Bの性質について述べています。正しいものを1つ選び、番号で答えなさい。
1 炭酸カルシウムは水に溶けないが、固体Bは水に溶けて中性を示す。
2 炭酸カルシウムは水に溶けないが、固体Bは水に溶けて酸性を示す。
3 炭酸カルシウムも固体Bも水に溶けて中性を示す。・
4 炭酸カルシウムも固体Bも水に溶けてアルカリ性を示す。
5 炭酸カルシウムは水に溶けて酸性、固体Bは水に溶けて中性を示す。
6 炭酸カルシウムは水に溶けてアルカリ性、固体Bは水に溶けて酸性を示す。
[実験2]図2のように、ペットボトルに炭酸カルレシウムの粉末と塩酸がはいった試験管を入れ、ふたをしめて全体の重さをはかった後、ペットボトルを横にしてよくふり混ぜたところ、炭酸カルシウムは二酸化炭素を発生してすべて溶け、無色透明の液体(A液)が残りました。そして再びペットボトル全体の重さをはかると、ふり混ぜる前と同じ値になりました。また、ペットボトルをふり混ぜる前後で、中の空気の量は一定で変化しないことがわかっています。(c)そしてある方法で、発生した二酸化炭素の重さを求めました。
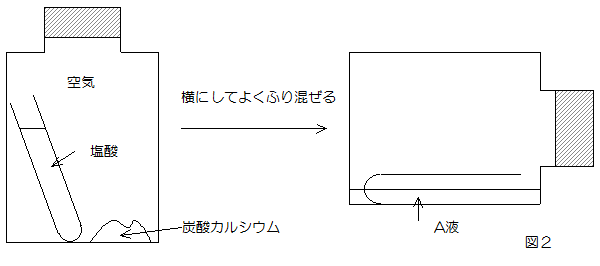
問4 下線部(c)の方法を説明しなさい。
[実験3]実験2の器具を用いて、炭酸カルシウム、塩酸、二酸化炭素の量の関係を調べるために、次の(I)・(Ⅱ)を行いました。
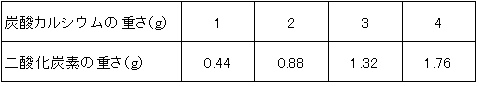
(I)塩酸20cm3に炭酸カルシウムを1~4g加えたとき、発生する二酸化炭素の重さを調べると下のような結果になりました。ただし、どの場合でも炭酸カルシウムはすべて二酸化炭素の発生に使われてなくなります。
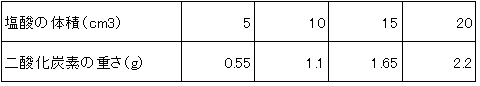
(Ⅱ)炭酸カルシウム10gに塩酸を5~20cm3加えたとき一発生する二酸化炭素の重さを調べると下のような結果になりました。ただし、どの場合でも塩酸はすべて二酸化炭素の発生に使われてなくなります。
問5 塩酸も炭酸カルシウムも残らずに二酸化炭素を発生させるには塩酸20cm3に炭酸カルシウムを何g加えればよいですか。
問6 塩酸20cm3に炭酸カルシウムを6g加えたとき、二酸化炭素は何g発生しますか。
問7 炭酸カルシウム10gに塩酸を十分に加えていくと、二酸化炭素は最大何g発生しますか。
【解説と解答】
炭酸カルシウムに塩酸を加えると、水と塩化カルシウムと二酸化炭素ができます。塩化カルシウム溶液は結晶した白い固体を水に溶かしたときにBTB反応が緑色であったことで、中性とわかります。
したがって、炭酸カルシウムと塩酸がちょうど化合すれば、残った水溶液というのは塩化カルシウムと水ということになります。
また塩酸が残っていれば、A液には塩化カルシウムと水と塩化水素が残ることになります。
問2の(1)で
「下線(a)のようになるのは、A液の中に2つのものがふくまれているからです。」というのを勘案すると、これは水と塩化カルシウムと読めば(ア)は緑、(イ)は中 ということになるでしょう。
ただ、これには反論がいくつかあり、十分な量の塩酸を入れているのだから、塩酸が残るはずである、という考え方、二酸化炭素が溶けたのだから、いずれにしても酸性になる、という考え方もあります。
で、塩酸が残っていると、A液には水、塩化水素、塩化カルシウムが残っていることになるので、(ア)黄 (イ)酸ということになるのですが、A液の中に2つのものが、にひっかかります。ただ、条件の読み方によっては酸性になるのには塩化水素と水が残っていたからだ、という考え方も一理あることはあるわけです。
ということで、あとは学校がどう判断したのか、ということになるのだろうと思います。私には(ア)緑、(イ)中、は誤りではないように思えます。
でここの判断で、当然問2の答えが割れます。
中性であると判断すれば(1)は水、塩化カルシウム となるでしょうし、酸性であると判断すれば(1)水、塩化水素ということになるでしょう。ここでひとつひっかかるのは「塩化カルシウム」が答えになるところでしょうか。
同様に
中性であると判断すれば(2)は水、酸性であると判断すれば(2)水(水蒸気)、塩化水素ということになるでしょう。
問3は炭酸カルシウムは水に溶けないが、固体B(塩化カルシウム)は水に溶けて中性をしめすので1が正しいでしょう。
問4
ふたをしたままでは、ふたつの重さががかわらないだけで、何がどうなったかがわかりません。
ふたをあけてA液の重さを量り、最初の重さから引く、というのが答えになるでしょう。
問5
(Ⅰ)4gまで入れて二酸化炭素の重さは比例していますから、1gの炭酸カルシウムを反応させると0.44gの二酸化炭素が発生しています。
(Ⅱ)炭酸10g、塩酸20㎝3で2.2gの二酸化炭素が出ていますから、2.2÷0.44=5gの炭酸カルシウムが20㎝3の塩酸と過不足なく反応したことになります。
問6
塩酸20㎝3と炭酸カルシウム6gでは、塩酸が不足するので、炭酸カルシウム5gと同じ量の二酸化炭素になるので、2.2gです。
問7
塩酸が十分にある状態では炭酸カルシウム10gで0.44×10=4.4gの二酸化炭素が発生します。
==============================================================
中学受験で子どもと普通に幸せになる方法、本日の記事は
ゲーム、やめる?
==============================================================
中学受験 算数オンライン塾
5月17日の問題
==============================================================

==============================================================

==============================================================
![]()
にほんブログ村








