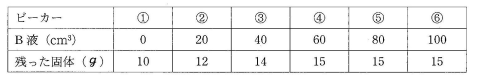
2010 フェリス中学の問題です。
6個のビーカー(①~⑥)を用意し、それぞれにA液(うすい塩酸またはうすい水酸化ナトリウム水よう液。すべて同じ種類の液体。)を100cm3ずつ入れました。
そこへB液(これもうすい塩酸またはうすい水酸化ナトリウム水よう液。ただしA液とは別の種類の液体。)を、表のように、①には加えず、②~⑥には20cm3~100cm3加えました。
各ビーカーの水よう液を温めて水を蒸発させ、残った固体の重さを測りました。その結果を表とグラフに示しました。
1 A液は、うすい塩酸ですか、それともうすい水酸化ナトリウム水よう液ですか。あてはまるものに○印をつけ、そう考えた理由を答えなさい。
2 残った固体が食塩だけであるビーカーの番号をすべて書きなさい。
3 B液を何cm3混ぜれば、A液とB液を混ぜたものがちょうど中性になると考えられますか。
4 B液を10cm3混ぜたとき、残った固体に含まれる食塩の重さは何gと考えられますか。
中和の問題です。
水酸化ナトリウム水溶液を固定して、塩酸を入れていけば、できる食塩はある一定量まで増えて、それ以上はできなくなります。水酸化ナトリウムがなくなった時点で塩酸だけになるので、塩酸は蒸発してしまいます。
この問題の場合、食塩が15gでこれ以上増えていきませんから、水酸化ナトリウムを固定して、塩酸を入れていったということになります。
または①の段階ですでに固体が残っているので、A液が水酸化ナトリウム水溶液と言っても良いでしょう。
(1)うすい水酸化ナトリウム水溶液 ○
理由 Bを60㎝3以上いれても固体が増えないから、Bの溶質は固体ではないので、Bは塩酸と決まるから。
(2)グラフから食塩が15gできた段階で、水酸化ナトリウムがなくなります。したがって全部が食塩なので、④、⑤、⑥が該当します。
(答え)④、⑤、⑥
(3)グラフの増え方からすると、④では本来16gになっていないといけないのですが、それが15gで止まったので、中和は50㎝3でおこったと考えられます。
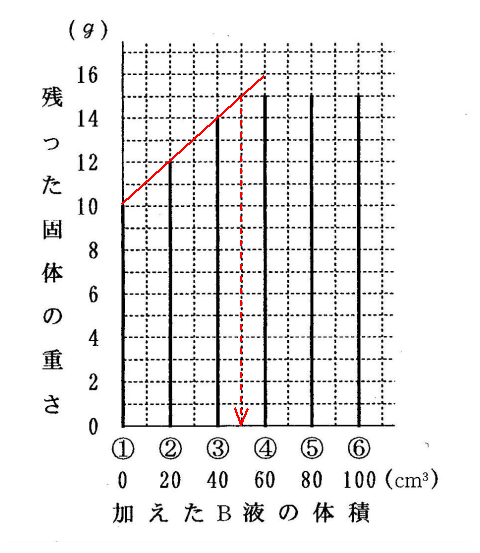
(答え)50㎝3
(4)水酸化ナトリウムの減り方をグラフにすると、以下の青い線になります。
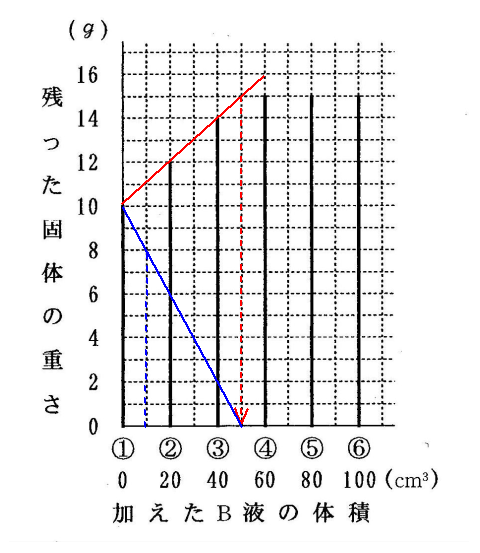
このとき、塩酸を10㎝3入れたときは8gが水酸化ナトリウムの量。固体の量は11gですから、その差が食塩の重さです。
11-8=3
(答え)3g
=============================================================
中学受験で子どもと普通に幸せになる方法、本日の記事は
読書感想文対策マニュアル?
==============================================================
中学受験 算数オンライン塾
7月14日の問題
==============================================================










