2012年豊島岡中の問題です。
以下の問いに答えなさい。ただし、割り切れない場合は小数第2位を四捨五入して小数第1位まで答えること。
塩酸と水酸化ナトリウム水溶液の中和について調べる実験をしました。
【実験1】:水酸化ナトリウム80gを水に溶かしてちょうど500mLの水溶液をつくりました。
【実験2】:【実験1】の水溶液を50mLずつビーカーにとり、それぞれのビーカーに事前に用意した塩酸を、体積を変えて加え、よく混ぜ合わせました。
【実験3】:【実験2】のそれぞれを熱して水分を蒸発させました。蒸発させた後、残った固体の重さを調べました。これをまとめると、次の表のようになりました。
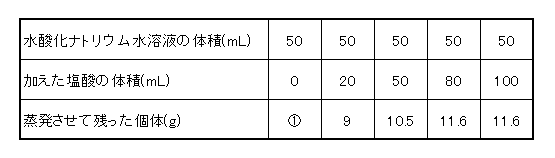
(1)①の重さを答えなさい。
(2)水酸化ナトリウム水溶液50mLを完全中和(過不足なく反応)するのに必要な塩酸は何mLですか。
(3)水酸化ナトリウム水溶液50mLに塩酸100mLを加えてよく混ぜた溶液を完全中和するのに,水酸化ナトリウムの固体をさらに何g加えればよいですか。
(4)水酸化ナトリウム水溶液50mLに、塩酸54mLを加えてよく混ぜた後、水を蒸発させると何gの固体が残りますか。
(5)(4)で答えた固体の中で、塩化ナトリウムは何gですか。
(1)水酸化ナトリウム水溶液を固定して、塩酸を加えています。表から塩酸を50mLいれてもまだ中和はしていません。塩酸が20mLから50mLへ、30mL増えるのに固体が10.5-9=1.5g増えていますから、0から20mLの間は
1.5÷3×2=1.0g増えているので、①は9-1=8gになります。
(答え)8g
(2)80mL加えたとき、中和になっていなければ10.5+1.5=12.0g になっていたはずですから、80mLの前で中和したことになります。
12.0-11.6=0.4 11.6ー10.5=1.1gより
30mLの11/15の22mL加わった時に中和したので、50+22=72mL
(答え)72mL
(3)水酸化ナトリウム水溶液:塩酸=50:72が中和の比になります。
水酸化ナトリウム50mLに塩酸100mLを加えると、塩酸100-72=28mLが余りますから、これに相当する水酸化ナトリウム水溶液は
50×28/72≒19.4mLです。500mLにつき80gでしたから
80×19.4/500≒3.1g
(答え)3.1g
(4)
72-54=18 54-0=54より54:18=3:1から下図のようになります。
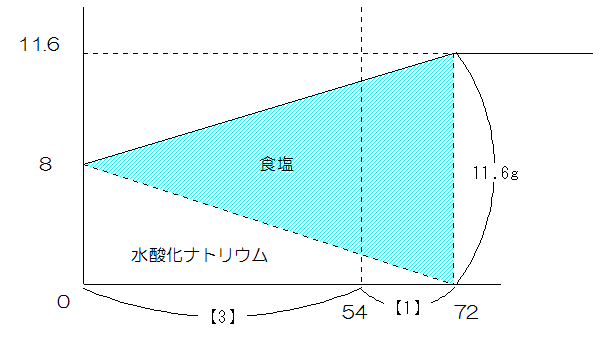
したがって、塩化ナトリウムは11.6×3/4=8.7g 水酸化ナトリウムは8×1/4=2gですから、固体は8.7+2=10.7gです。
(答え)10.7g
(5)
(答え)8.7g
==============================================================
中学受験で子どもと普通に幸せになる方法、本日の記事は
合格鉛筆(2)
==============================================================
中学受験 算数オンライン塾
1月26日の問題
==============================================================

==============================================================
お知らせ
算数5年前期第1回 算数オンライン塾「約数と倍数」をリリースしました。
詳しくはこちらから
==============================================================

==============================================================
![]()
にほんブログ村








